8.液體、固體
離子鍵 > 氫鍵(強F.O.N配H,偶極) > 偶極-偶極力(不對稱極性分子) > 凡德瓦(接觸面)
分子量相等時作用力大小:
1級胺 >2級胺 >3級胺 >COOH >C三N >OH >C=O > R-X > R-H
作用力大> 沸點高 熔點低 蒸氣壓小
離子電荷為+2以上,靜電作用力強,熔點越大 *例外: BeX2和AlX3 ,熔點相對小(極化了)
離子半徑越小,晶格能越大。
水合:離子溶解於極性溶劑內(水),離子,偶極作用,半徑小,電荷強 > 大
分子偶極矩:兩個鍵合原子間的電子分佈不均產生極性,向量抵銷後為分子偶極矩。
對稱分子沒有偶極矩,屬於非極性 ex:CCl4
氫鍵:共價鍵結合其它原子的氫與另一個原子間,HF > H2O > NH3 (X-H…Y)
電負度越大,氫鍵越強,氫鍵造成更高的熔點和沸點 ,但沸點H2O > HF > NH3
倫敦分散力 (LDF),一種凡得瓦力,非極性分子產生的瞬間偶極引力 直鏈>分支
沸點比較(難離開):有氫鍵 > 高極性 > 低極性 ;分子量大則大, 直鏈>分支
熔點比較(易離開):*與沸點無正相關, 分子對稱度高熔點高(para > 苯 > ortho > meta)
凝固點:溶解離子/分子越多,粒子濃度增加,凝固點下降 (不解離如葡萄糖視為1)
*常見離子融液:有長烷基的咪唑(1,3-二氮唑) 五元環兩個N帶長鏈、PF6-
立方晶體: 體面~4(r) 32 粒24 812 (電話號碼 4322 4812 )
金屬能帶模型:判斷熔點沸點
離子固體:靜電力大,無延展性,高熔點高沸點;網狀>離子>分子
離子晶體:
陽離子半徑小於0.732陰離子:配位數6,CI-面心立方點,Na+晶格邊緣和中心,
NaCI,晶格8離子
陽離子半徑小於0.414陰離子:配位數4,S-2組成四面體ZnS,包Zn+2
陰陽離子不相等
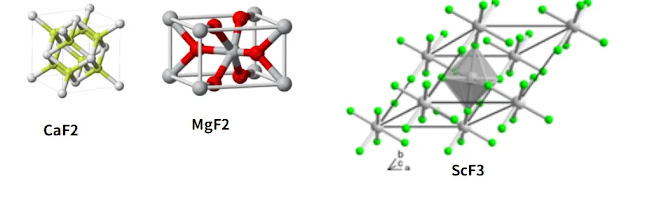
CaF2:Ca+2佔據面心立方點,F-佔據四面體洞 (螢石結構) (8-4)
MgF2:Mg+2佔據體心立方點,F- 包圍立方晶格的Mg+2形成八面體 (6-3)
ScF3:Sc+3佔據簡單立方點,F-佔據簡單立方邊緣 (6-2)
碳:Sp3=鑽石,Sp2=石墨,石墨捲成奈米碳管,C60=Sp2=12五邊+20六邊型
半導體:n型>矽/鍺加5A族ns2np3,多一電子 ;p型>矽/鍺加3A族ns2np1,電洞得電子
*奈米材料:表面積特大= 熔點降低,反應速率增加





0 留言
如有任何有趣口訣/錯漏歡迎留言,隨時調整更新!