13.電化學
觀察氧化數變化量=電子得失情形 電池放電=自由能G換成電功E
還原力:氣體最強Cs 溶液最強Li ;1A族 K > Na > Li 2A中Mg最弱
△G0 = W = - nFE0 自由能 = 功 = - 電子移動莫耳數 *96500 *電位差 V / J
氧化還原電位: ΔG0=-nFE0 = - RT lnK = 8.314*298*平衡常數 lnK = nFE / RT
G:吉布斯自由能、吉布斯函數、自由焓
n:(平衡時移動)電子的莫耳數
F:法拉第常數(96500 J/mol或23.062 Kcal/mol)莫耳電子攜帶的電荷
E0:題目會給,還原電位差,算原反應,並非平衡
電化學的R:8.314 J /mol·K
*電池放電時將自由能轉為電功,故△G < 0 △E > 0
E=E’ – 0.0591 / n *logQ n=電子Q=低濃度/高濃 ; 當E值為正=自發
安培*秒 / 96500= ___mol電子轉移 安培=96500庫倫電量/s
安培*秒 / 96500= ___mol電子轉移 安培=96500庫倫電量/s
ex: 鎳鎘電池 消耗5g鎳(MW=112.4) Cd ➝ Cd(OH)2 ,以2安培充電,需充多久小時
5/112.4 *2 (mol e-) = 2/1 (sec) *1(mol e-)/96500(c)*3600 (s) / 1 (hr) * hr ;hr=1.2
能斯特方程式:E = E' + RT log ([ox]/[red]) / nF
25度的簡化:E = E' + 0.06* log ([ox]/[red]) / n
[ox]/[red]:溶解度積Ksp (參與電極反應所有物質濃度乘積與反應產物濃度乘積之比)
n:半反應式的電子轉移mole數
ex:知道物質e-解離電位 E - E' = -0.95v = 0.06* log Ksp ,Ksp=10^-15.8
+陰還拿 +35%陰險番仔
伏打電池:陽極( -)氧化反應,高活性丟e- 自身被氧化=還原劑 Zn H Ni
;陰極(+)還原反應,拿e-質量增;鹽橋>供左右離子 Cr Ag Cu
與通過電量相關,左右產生相同莫耳數離子
增加鹽橋(NaNO3 : Na+補陰極(+),NO3補陽極(-) )或離子透膜平衡氧化還原累積的電荷
兩電池順接(正接負)電位相加;兩電池逆接(正接正)電位小的電池被電解
勒沙特列原理 降低濃度> 反應傾向增加 (補不足
標準還原電位:以H+作為基準點(0V),還原電位為負丟電子(Li最負),正則得電子(F最大)
氧化電位:還原力,供電子能力,與還原電位相反
*標準還原電位計算電池電位:兩半反應直接相加
單元素+化合物 or燃燒 >必為氧化還原 1.2A強還原 6.7A強氧化
氧化劑 > 得電子,自身還原 其他物質氧化 ;還原劑 > 丟電子,自身氧化 其他物質還原
氧化劑 > 得電子,自身還原 其他物質氧化 ;還原劑 > 丟電子,自身氧化 其他物質還原
你如假設被撕開,那美女猛 心割鐵,又喜錢,請總共一百斤
*鋰>銣>鉀>銫>鋇>鍶>鈣 >鈉>鎂>鋁>錳> (碳) >鋅>鉻>鐵>鎳>錫>鉛>(氫)
>銅>汞>銀>鉑>金 比氫大=與冷水/水蒸氣/酸作用產生H2
電池:
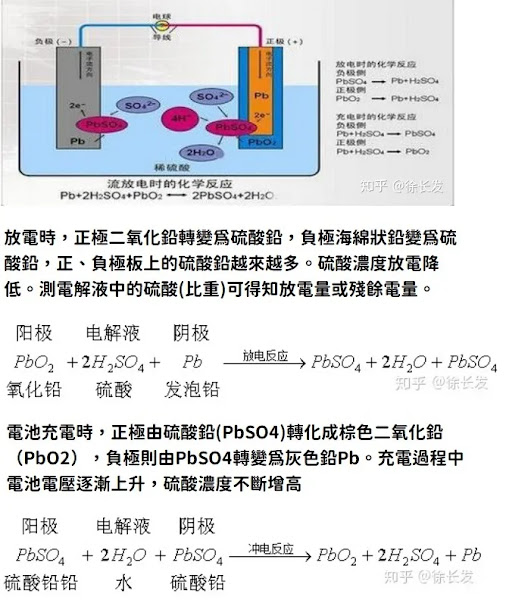
鉛蓄電池:陽極( -)=Pb+SO42- → PbSO4+2e-;
陰極(+):PbO2+4H+.+SO42- + 2e- → PbSO4 + 2H2O
全反應=Pb + PbO2+2H2SO4→2PbSO4 +2H2O
乾電池 :陽極( -)Zn 陰極(+)C 3.4V *碳棒不獲得電子,只是傳導電子給二氧化錳
鹼性電池:陽極( -) Zn 陰極(+) MnO2 (電解液KOH)
水銀電池:陽極( -) Zn 陰極(+) HgO (電解液KOH)
鎳氫電池 :陽極( -)金屬氫化物 陰極(+)Ni(OH)2 (電解液KOH) *可充電
鋰離子電池:陽極(負極)石墨丟鋰離子給陰極(正極)鋰鐵磷酸鹽。 鋰離子與電子同時釋放,
鋰離子穿過內隔離膜前往陰極(正極),電子則經由外電路往陰極(正極)。 *可充電
燃料電池: H2+O2>H2O需鉑或鎳催化 0.7V *與鋰離子電池類似,
陽極丟H+,電子由外電路往陰極(正極)。
電解:
陽極 丟e- :F-除外的鹵素氧化;鹼性,氧化OH- 析出O2 ;陰離子氧化H2O 析出O2 H+
陰極 得e- : 低活金屬陽離子+n 還原析出金屬; 酸性,還原H+ 析出H2 ;
1A2A金屬~還原H2O 析出H2 OH-
*碳棒作為陽極電解時不會釋出氧氣(不參與反應)
酚肽指示鹼性>陰極變粉 活性小金屬優先還原
*F沒法直接電解,要在KF溶液中電解才可析出
鹼氯電解:電解食鹽水,陽極產生Cl2,陰極產生H2和NaOH (離子結合)
*以離子交換膜防止NaOH 與Cl2反應
防止生鏽:接活性金屬,活性金屬優先丟電子氧化
電鍍:陽極( -)放欲鍍金屬,丟電子,產生離子,在陰極(+) 還原鍍上薄層
保護基:大多酸性 先拆雙鍵 接上其他基團x2 才能其他反應
內含電子的反應相消不能直接消電子: A電能*電子數 +B電能*電子數 / 預計AB相消產物電子數




0 留言
如有任何有趣口訣/錯漏歡迎留言,隨時調整更新!