5.原子結構、週期表
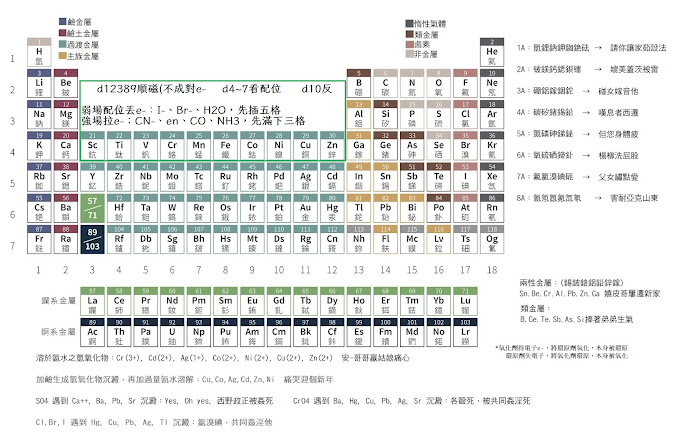
1A鹼金 2A鹼土 7A鹵素 8A惰性 B族都是過渡元素,價電子優先填入3d 4d 5d 6d
*第三周期最外層有3s 3p 4d 但3d能量高於4s,故只有8種元素
游離能:第一游離能最小,越後面丟電子需要的游離能越大
*HE+的游離能約為H游離能的2^2=4倍 (變兩個質子拉一顆電子,平方)
*移去 s、p、d、f 電子所需游離能大小順序為 s >p >d >f
ex: 第二週期元素游離能大小:Li < B < Be <C < O < N <F <Ne
同電荷:帶正電>>帶負電;同週期:8A>7 5 6 4 2 3 >1A;同族:n越大,離核遠游離能小
金屬:左下游離小(丟電子) 非金屬:右上游離大 *鈍氣游離能大(第二、三游離能丟到
金屬:左下游離小(丟電子) 非金屬:右上游離大 *鈍氣游離能大(第二、三游離能丟到
原子半徑:越往左下越大 ;離子半徑:A- > A > A+ 等離不同原子則看核電荷大=半徑小
電負度:游離能越大,電負度越大,通常週期表右、上增加,但過渡元素區大多右、下增加
F4.0最大,最不易丟電子
F4.0最大,最不易丟電子
熔沸點: 例外:汞Hg 熔 -39度; 鎵Ga 熔30度 (但沸點特高2200度)
同族元素從上到下,金屬熔點遞減,非金屬熔點遞增
同周期元素隨原子序數的遞增,金屬的熔點遞增,非金屬的熔點遞減;
光電效應:
γ
電磁輻射能量E=hv=hc/ λ h是普朗克常數(6.626 × 10^-34 m2 kg / s),ν是入射光子的頻率
電磁輻射能量E=hv=hc/ λ h是普朗克常數(6.626 × 10^-34 m2 kg / s),ν是入射光子的頻率
頻率v高 / 波長λ短 =能量大 (伽瑪) γX射射 紫紅 (威武現)微無線
波長:10^-10m γ射線< X射線< 紫外線 <可見光400-750nm <紅外線 <微波 <無線電 100m
Xray>測晶體結構 電子移轉吸收>紫外光~可見 分子振動吸收>紅外光 分子轉動吸收>微波
光電效應 hv=hv’+1/2mv^2 =W’+Ek 1ev=1.6*10^-19J
*過渡金屬顏色:因為d軌域電子躍遷,產生互補色,紅700~紫400 nm
氫原子光譜 基態____________1____2_345..
雷德堡方程式 v=3.28*10^15*(1/ n^2- 1 /n’ ^2) v單位=1/sec
波爾氫原子模型 hv=△E=313.6*(1/ n^2- 1 /n’ ^2) Kcal/mol 單個=13.6ev
氫原子由n階回基態,全明線=n*(n-1)/2條 紫外光=n-1條 可見光=n-2條 紅外=總-紫外-可見
電子由n=1 躍遷到n= ∞ 需要13.6ev = 311.6 Kcal/mol = 3.3*10^15 Hz = 90nm
電子由n=2 躍遷到n= ∞ 需要1/2^2 的能量 = 3.4ev .... ;n=3 躍遷到n= ∞ 1/3^2 =1.51ev ...
電子由n=2 躍遷到n= 1 需要 1/1^2 - 1/2^2 的能量 = 10.2 ev ...
ex:電子n=5 躍遷n= 2 波長:90nm* 1 / [1/2^2 - 1/5^2] = 90nm* 100/21= 434nm(藍光)
其他原子游離能為質子數平方*氫原子游離能 ex: He+ = 2^2 * 13.6ev
氫原子能階:1s<2s = 2p<3s = 3p = 3d<4s = 4p… spdfg (只看n)
多原子能階:1s<2s<2p<3s <3p<4s<3d<4p<… (由n+l決定)
分子光解離能量:h(分子常數) * (3*10^8) * (6^10^23) / nm(10^-9 ) * 1000 單位KJ/mol
一維盒中質點 :波節存在。在盒內某些地方找到粒子的機率是零
E = h^2*K^2 / 2m = n^2*h^2 / 8mL^2 n=1,2,3..... ,基態最小能量:3h^2 / 8mL^2
粒子束縛於一維無限深方形盒內,盒寬為 L 。盒內位勢為 0 ,盒外位勢為無限大。粒子只能移動於束縛的方向( x 方向) ,n 是正值的整數,h 是普朗克常數,m 是粒子質量。
L=nλ/2 其中,L 是波長,n 是正值整數。
*盒長L,最長駐波為2L ; 波的零點(經X軸的位置)粒子不存在
氫原子波函數
氫原子能階= -2.18*10^-18 J
s軌域為球形、p軌域為雙葉 從2p開始、d軌域為四葉或貫穿甜甜圈 3d開始
洪特規則:電子優先以自旋相同的方式佔據不同的軌道,更加穩定
氫原子能階:1s <2s = 2p <3s = 3p = 3d <4s = 4p… spdfg (只看n)
多原子能階:1s <2s<2p< 3s <3p< 4s<3d <4p<… (由n+l決定)
*注意原子序21以下 4s < 3d(斥力大),e-先給4s
1 H 氫 : 1s1 2 He 氦 : 1s2
3 Li 鋰 : [He] 2s1 4 Be 鈹 : [He] 2s2 5 B 硼 : [He] 2s2 2p1.....
20 Ca 鈣 : [Ar] 4s2 21 Sc 鈧 : [Ar] 3d1 4s2.. 過渡3d1~10 跳4和9
**例外常考: 24Cr鉻 4s1先3d5 [Ar] 3d5 4s1 ;29Cu銅 4s1先3d10 [Ar] 3d10 4s1
晶場理論:過渡元素有五種相等能量的 d 軌域(d1-10)
錯合物:檢查中心原子d軌域, 常考:週期表21-30 鈧~鋅 (d1~d10)
d4:Cr+2,Mn+3 ;d5:Mn+2,Fe+3 ;d6:Fe+2,Co+3 ;d7:Co+2
ex: K3[Fe(CN)6]:Fe+3 、[Mn(CN)6]-4:Mn+2 先拔4s位置,+2=原本,+3=d降1
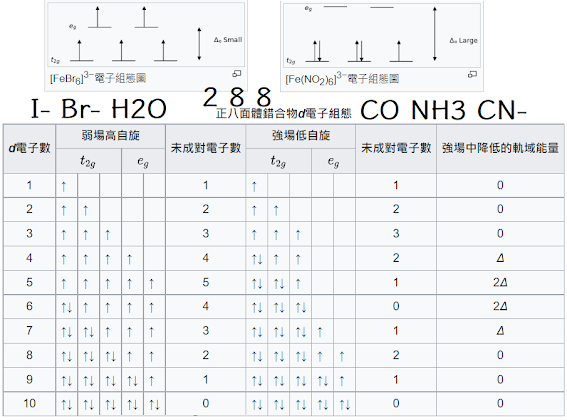
強場配位基得電子:CN−、en、CO、NH3,d電子在能階低三軌,低自旋(先排滿下三格)
弱場配位基丟電子:I−、Br−、H2O,d電子在能階高五軌,高自旋 (先插滿五格)
磁性與配位基無關之錯合物: d1-d3,d8-d10 12389順 10反
順磁性:有不成對電子 (1A族 O2 NO2...) ; 逆磁性:沒有不成對電子
錯合物顏色:根據六色表(無靛色),反射=目視顏色,並吸收對向互補色
(n、l、ml、ms) [主量子、角量子(形狀)、磁量子(方向)、自旋量子]
n=軌域1..n l=0~n-1 (spdfg) ml=方向+l..0..-l ms=自旋+-1/2
n必>l、 不符合=不存在
特定n值的主能階有n^2個軌域,可填2*n^2電子
特定l值的主能階有2l+1個軌域,可填2*(2l+1)電子
Mg+2 拿走兩個電子, 1s2 2s2 2p6 ;O-2 多兩個電子, 1s2 2s2 2p6
*注意z21-30過度金屬離子3d軌域能量低 先拿 先填4s :Cu > Cu+ = 4s1 3d10 > 3d10
順磁性:有未成對電子,受磁場吸引;反磁性:全為成對電子,受磁場排斥
*H-H鍵長 < C三C < O=O < C=C < Cl-Cl < I-I (原子大小)
*光譜化學序列:電子躍遷到高能階所需的能量,越大,能吸收的可見光波長就越短
I− < Br− < S2− < Cl− < NO3− < F− < OH− < H2O < NH3 < en (乙二胺)< NO2−
4.酸鹼反應 ↼ 5.原子結構、週期表 ⇀ 6.化學鍵、分子形狀






0 留言
如有任何有趣口訣/錯漏歡迎留言,隨時調整更新!